Canada tid 2022-01-24, RhoVac, en farmaceutisk virksomhed med fokus på tumorimmunologi, annoncerede, at dens patentansøgning (nr. 2710061) for dets cancerpeptidvaccine RV001 vil blive godkendt af Canadian Intellectual Property Office (CIPO).Tidligere har virksomheden opnået patenter relateret til RV001 i USA, Europa og Japan.Denne patentbevilling vil give bredere beskyttelse af RV001 på nøglemarkeder og hæve virksomhedens patentbarrierer.
Ligesom den tidligere udstedte patentansøgning dækker dette patent RV001 cancervaccinen og dens varianter, samt dens anvendelse i behandlingen/forebyggelsen af RhoC-udtrykkende metastatisk cancer.Blandt dem er RhoC et tumorassocieret antigen (TAA), der er overudtrykt i forskellige tumorcelletyper.Når først det er givet, vil patentet udløbe i 2028-12 og forventes at blive forlænget ved opnåelse af et Certificate of Supplementary Protection (CSP).
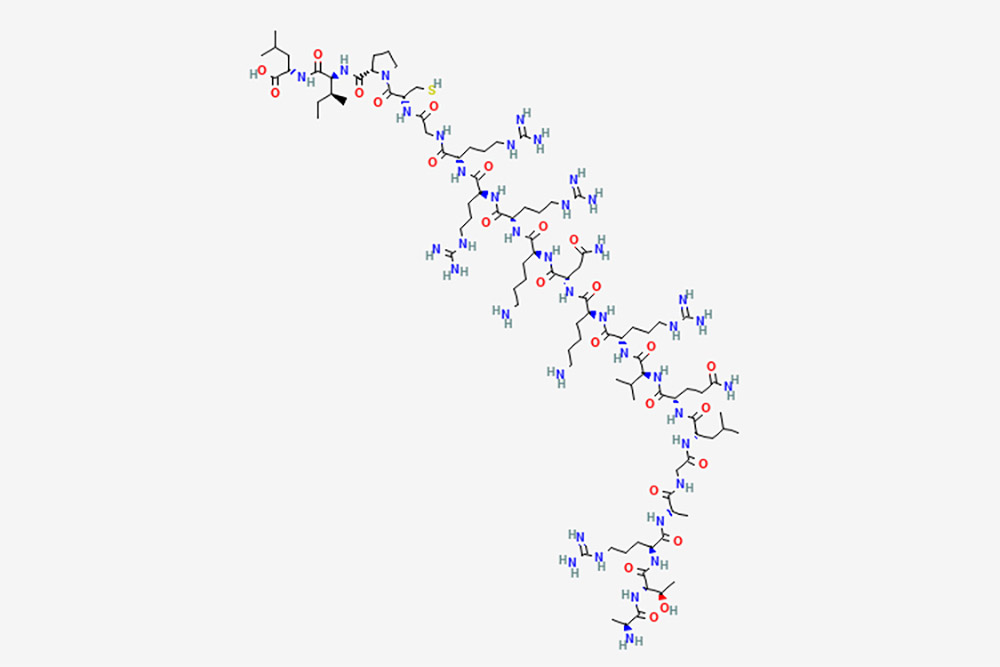
01 Onilcamotide
Onilcamotide er en cancervaccine bestående af immunogene peptider afledt af Ras homologt familiemedlem C (RhoC), som kan emulgeres i immunadjuvansen montanid ISA-51 med potentielle immunmodulerende og antitumoraktiviteter.Subkutan administration af Onilcamotide stimulerer værtens immunsystem til at igangsætte et humoralt og cytotoksisk T-lymfocyt (CTL)-respons på RhoC-udtrykkende tumorceller, hvorved tumorcellerne lyseres.
2020-11 blev RV001 tildelt Fast Track-betegnelse af FDA.
02 Kliniske forsøg
I 2018 blev det kliniske fase I/IIa-studie med Onilcamotide til behandling af prostatacancer godkendt, og i alt 21 patienter blev indskrevet.Resultaterne viste, at Onilcamotide var sikkert og godt tolereret.Derudover udviklede patienterne stærke og holdbare immunresponser efter behandlingen.I 2021 viste en opfølgning af 19 af disse forsøgspersoner, tre år efter afsluttet behandling med RhoVac, at disse forsøgspersoner ikke havde udviklet nogen metastaser eller modtaget yderligere behandling og ikke havde nogen signifikant prostataspecifik antigen (PSA) progression..Af disse havde 16 forsøgspersoner ingen påviselig PSA, og 3 forsøgspersoner havde langsom PSA-progression.PSA er et protein produceret af prostatakirtlen og bruges til at spore udviklingen af kendt prostatakræft.
I 2019 blev RV001 fase IIb klinisk BraVac (randomiseret, dobbeltblind, placebokontrolleret) påbegyndt for at evaluere dens effektivitet til at forebygge eller begrænse udviklingen af metastatisk prostatacancer efter operation/stråling.Dette IIb kliniske forsøg er et internationalt multicenterstudie, der rekrutterer forsøgspersoner i 6 europæiske lande (Danmark, Finland, Sverige, Belgien, Tyskland og Storbritannien) og USA.Forsøget afsluttede patientrekruttering i 2021-09, med i alt ca. 175 forsøgspersoner tilmeldt, og afsluttes i 2022H1.Derudover planlægger RhoVac at udføre prækliniske eksplorative undersøgelser med det formål at give vejledende beviser for udvidelsen af RV001 i indikationer.
Derudover gennemførte sikkerhedsovervågningsudvalget også en foreløbig sikkerhedsgennemgang af RV001 i 2021-07, og der blev ikke fundet uventede uønskede hændelser, hvilket var i overensstemmelse med de tidligere fase I/II kliniske resultater.
Indlægstid: 17. februar 2022