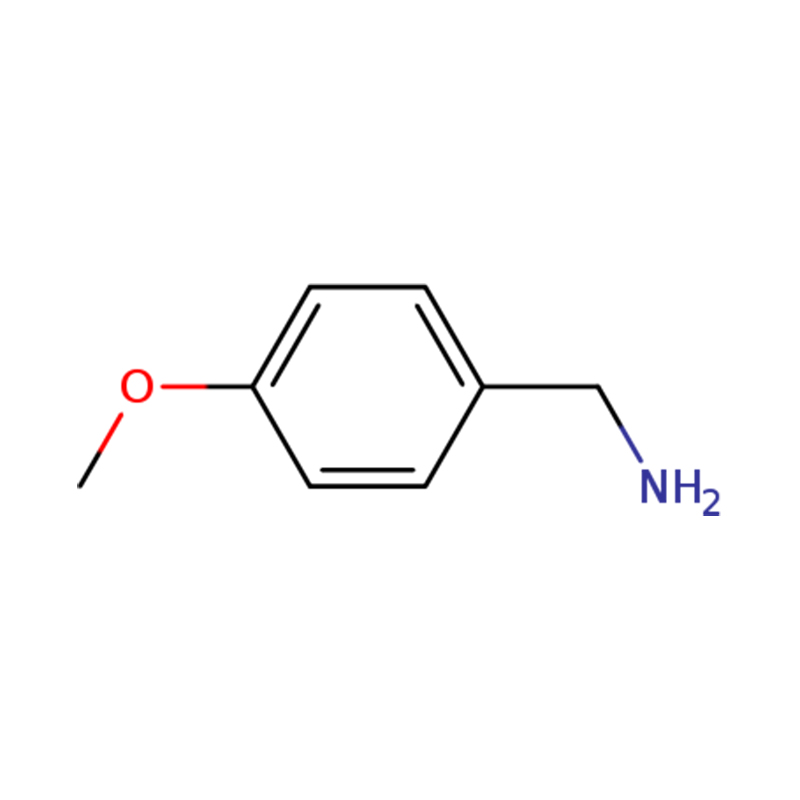
1-(4-METHOXYPHENYL)METHANAMIN
Produktdetaljer
| CasNr. | 2393-23-9 | Leveringstid | inden for 10 dage |
| Molekylær | C8H11NO | Produktionskapacitet | 1 metrisk ton/dag |
| Udseende | Klar, farveløs til let gul væske | Renhed | 99% min |
| Anvendelse | Farmaceutiske mellemprodukter | Opbevaring | Stuetemperatur, mørk, forseglet |
| Grænsenummer | 1 kilogram | Transport | Luft, sø, ekspres. |
| Tæthed | 1,05 g/m Lat25°C (lit.) | Kogepunkt | 236-237°C (lit.) |
| Smeltende Ponit | -10°C | Brydningsindeks | n20/D1.546 (lit.) |
| Flammepunkt: | >100°C | Opløselighed | Meget opløselig i vand |
| Navn | p-anisylamin eller (4-methoxyphenyl)methanamin |
Synonymer
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETHYLANISOL; 4-METHOXYBENZYLAMIN; P-Methoxybenzylaminhydrochlorid 173,64; 4-Methoxybenzylamin, 98+%; for Sparfloxacin; P-METHOXYBENZYLAMINHYDROCHLORID
Anvendelse
Det kan bruges til syntese af farmaceutiske mellemprodukter. Det er let skadeligt for vand. Lad ikke ufortyndede eller store mængder af produkter komme i kontakt med grundvand, vandveje eller kloaksystemer. Udled ikke materialer i det omgivende miljø uden tilladelse fra myndighederne for at undgå kontakt med oxider, syrer, luft og kuldioxid. Hold beholderen lukket, anbring den i en tæt udsugningsanordning og opbevar den et køligt og tørt sted.
QC-laboratorium
Et separat kvalitetssikringslaboratorium er placeret på stedet, hvor kemiske, fysiske test, mikrobielle test, stabilitetsundersøgelser og instrumenttest såsom IR, UV, HPLC og GC udføres for råmaterialer og færdige produkter. Hele området er adgangskontrolleret og velholdt med tilstrækkelige analytiske instrumenter til det tilsigtede testformål. Alle instrumenter er velmærkede og korrekt kalibrerede.
QA
QA er ansvarlig for at evaluere og kategorisere afvigelserne i niveauer af større betydning, generelt niveau og mindre betydning. For alle niveauer af afvigelser er en undersøgelse for at identificere den grundlæggende eller potentielle årsag nødvendig. Undersøgelsen skal afsluttes inden for 7 arbejdsdage. Produktkonsekvensanalysen sammen med CAPA-planen er også påkrævet, når undersøgelsen er afsluttet, og den grundlæggende årsag er identificeret. Afvigelsen lukkes, når CAPA er implementeret. Alle niveauafvigelser skal godkendes af QA-chefen. Efter implementering bekræftes CAPA's effektivitet baseret på planen.