Baggrund og studiedesign
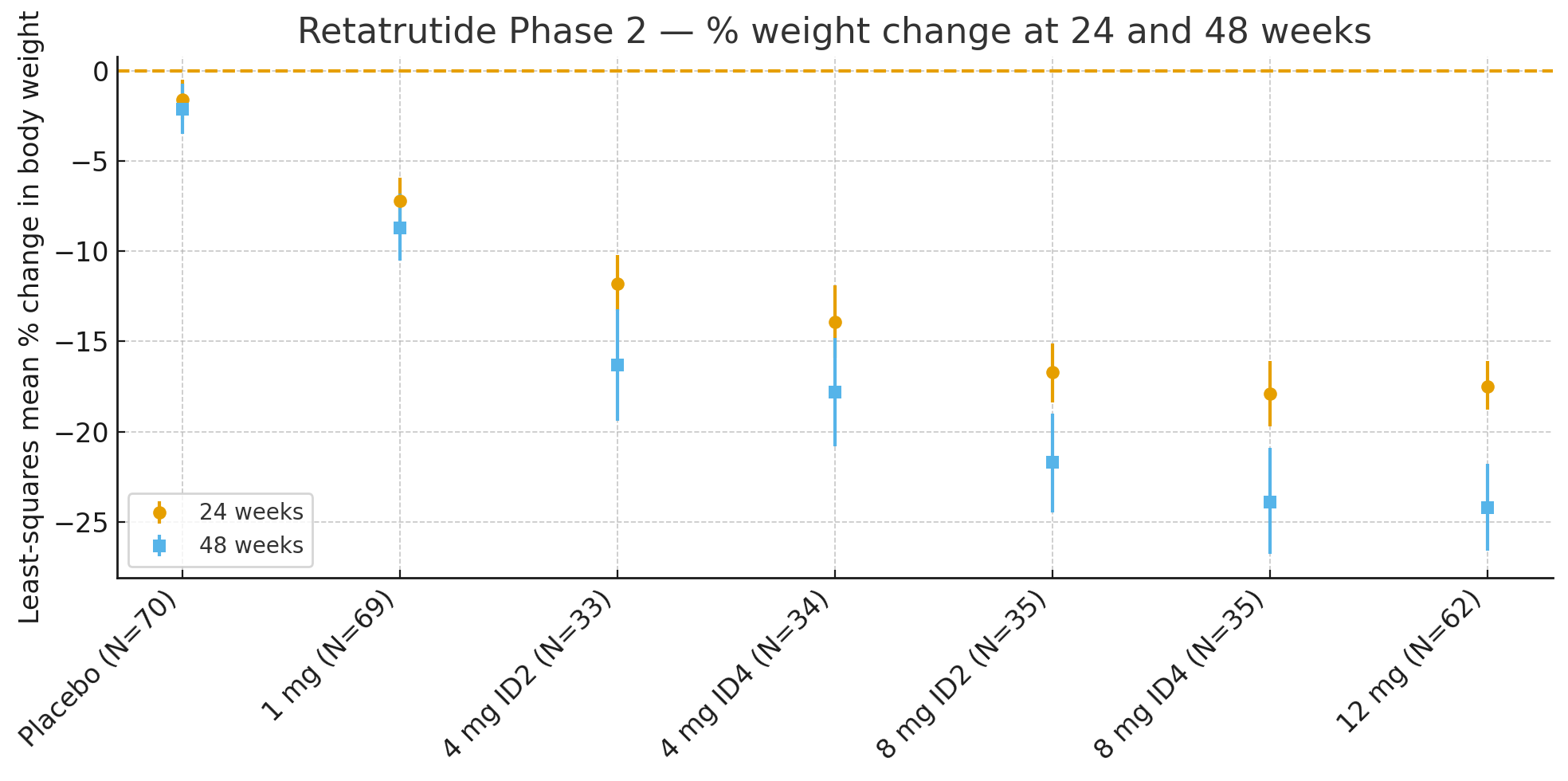
Retatrutide (LY3437943) er et nyt enkeltpeptidlægemiddel, der aktiverertre receptorer samtidigtGIP, GLP-1 og glukagon. For at evaluere dets effekt og sikkerhed hos personer med fedme, men uden diabetes, blev der udført et randomiseret, dobbeltblindet, placebokontrolleret fase 2-forsøg (NCT04881760). I alt338 deltageremed et BMI ≥30 eller ≥27 med mindst én vægtrelateret komorbiditet blev randomiseret til at modtage placebo eller retatrutid (1 mg, 4 mg med to titreringsskemaer, 8 mg med to titreringsskemaer eller 12 mg) administreret én gang ugentligt ved subkutan injektion i 48 uger.primært endepunktvar den procentvise ændring i kropsvægt efter 24 uger, med sekundære endepunkter inklusive vægtændring efter 48 uger og kategoriske vægttabstærskler (≥5 %, ≥10 %, ≥15 %).
Nøgleresultater
-
24 ugerMindste kvadraters gennemsnitlige procentvise ændring i kropsvægt i forhold til baseline var
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (kombineret): −12,9%
-
8 mg (kombineret): −17,3%
-
12 mg: −17,5%
-
-
48 ugerProcentvis ændring i kropsvægt var
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (kombineret): −17,1%
-
8 mg (kombineret): −22,8%
-
12 mg: −24,2%
-
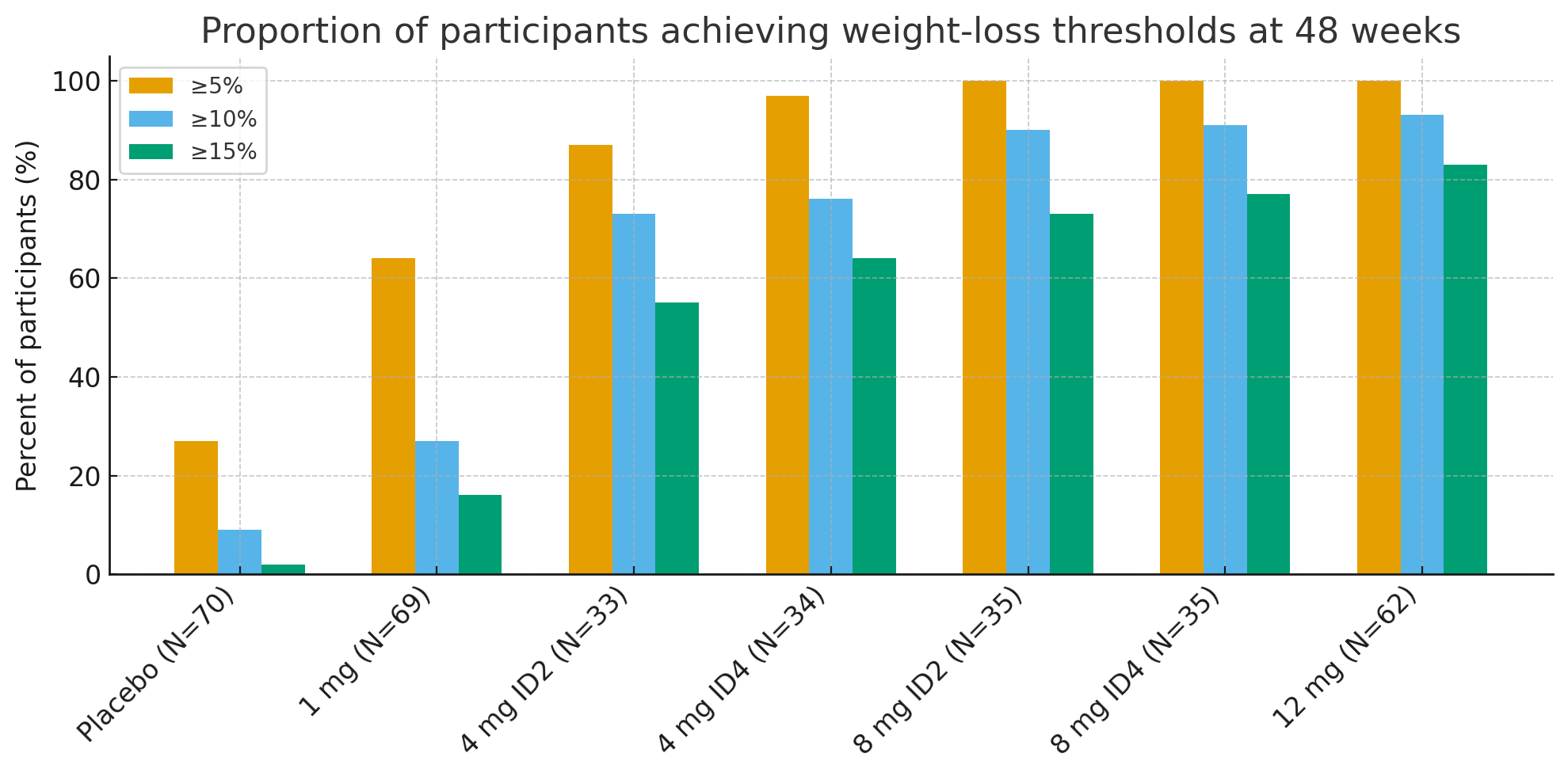
Efter 48 uger var andelen af deltagere, der opnåede klinisk meningsfulde vægttabstærskler, slående:
-
≥5% vægttab: 27% med placebo vs. 92-100% i aktive grupper
-
≥10%: 9% med placebo vs. 73-93% i aktive grupper
-
≥15%: 2% med placebo vs. 55-83% i aktive grupper
I 12 mg-gruppen, op til26% af deltagerne tabte ≥30% af deres baselinevægt, et vægttab i størrelsesordenen sammenlignelig med fedmekirurgi.
Sikkerhed
De mest almindelige bivirkninger var gastrointestinale (kvalme, opkastning, diarré), generelt milde til moderate og dosisrelaterede. Lavere startdoser (2 mg titrering) reducerede disse hændelser. Dosisrelaterede stigninger i hjertefrekvensen blev observeret, som toppede i uge 24 og derefter faldt. Seponeringsraterne varierede fra 6-16% på tværs af aktive grupper, noget højere end placebo.
Konklusioner
Hos voksne med fedme uden diabetes producerede ugentlig subkutan retatrutid i 48 ugerbetydelige, dosisafhængige reduktioner i kropsvægt(op til ~24% gennemsnitligt tab ved den højeste dosis), sammen med forbedringer i kardiometaboliske markører. Gastrointestinale bivirkninger var hyppige, men håndterbare med titrering. Disse fase 2-fund tyder på, at retatrutid kan repræsentere en ny terapeutisk benchmark for fedme, i afventning af bekræftelse i større, langsigtede fase 3-forsøg.
Opslagstidspunkt: 28. september 2025